2017-08-23
CAR-T疗法作为最有前景的肿瘤治疗方式之一,其抗肿瘤效果离不开T细胞的活性及扩增能力等,上一期我们已经介绍关键性细胞因子的加入会改善T细胞效力,克服免疫抑制微环境,提高CAR-T疗法在液体瘤乃至实体瘤的治疗效果。今天我们就继续介绍这种名为“Armored CAR-T”(装甲)的细胞疗法,和一种新的助力这种CAR-T的明星分子--- 免疫调节因子IL-18。
首先,我们一起了解一下什么是Armored CAR-T?
Armored CAR-T:Armored译为装甲,即赋予CAR-T细胞一个装备使其更加强大。具体是指在第二/第三代CAR-T 的基础上共表达一些关键的细胞因子或共刺激配体,即第四代CAR-T[1]。
意义:不管是血液瘤还是实体瘤,CAR-T细胞活性短、低增殖、抑制肿瘤微环境会抑制T细胞活性,细胞因子或共刺激配体的加入起可以到免疫调节作用,显著提升T细胞扩增活性和寿命,锦上添花。
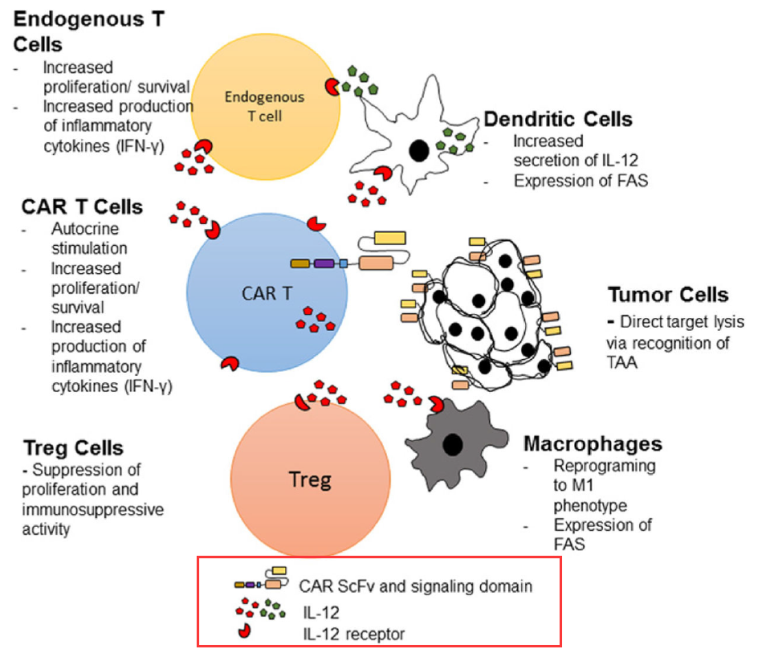
举例: IL-12:系统注射IL-12细胞因子会引起严重的炎症,但共表达IL-12的第四代CAR-T细胞来实现局部表达后,可在肿瘤病灶处招募NK细胞,或者直接逆转被耗竭的肿瘤浸润性T淋巴细胞,从而有效克服肿瘤免疫抑制微环境,并能增强CD8+T细胞和NK细胞的细胞毒性。如下图为共表达IL-12的Armored CAR-T可以提高CAR-T功效[1]。
由于目前以共表达细胞因子居多,因此狭义的四代CAR-T即Armored CAR-T可理解为共表达细胞因子,广义上为表达免疫调节因子,如表达CD40L(TNFR家族的CD40配体)和4-1BBL(共刺激配体),它们可以对抗原递呈细胞进行额外的共刺激,增强T细胞活性[1]。下图为表达4-1BBL,共刺激受体4-1BB/4-1BBL可促进T细胞增殖,促使DC细胞活化并分泌细胞因子,并提升细胞溶解能力。

因此,CAR-T设计中加入细胞因子(IL-7,IL-15、IL-18以及IL-21等),可以促进T细胞的增殖活化以及杀伤功能。继上一期我们已经了解了IL-7的免疫功效,本期就先为大家介绍一下细胞因子IL-18的功能及与肿瘤免疫的关系。
IL-18(interleukin-18,IL18)是近年来发现的一种重要的免疫调节因子,可诱导免疫细胞的增殖并增强其活性,近年来其在抗肿瘤、抗感染以及免疫调节方面的作用更是被广泛研究,这些都为CAR-T效力的提升以突破传统局限提供了理论依据和基础。下面一起来了解一下IL-18的免疫功能吧。
一、 IL-18的发现
IL-18发现于1995年,因可诱导细胞产生IFN-γ,被称为干扰素诱导因子(IFN-γ Inducing Factor, IGIF),随后发现其还有促进粒细胞-巨噬细胞集落刺激因子(GM-CSF)的产生和降低IL-10的产生等功能,被重新命名为IL-18,归属于IL-1家族。人和小鼠的IL-18主要由巨噬细胞产生,单核细胞、树突状细胞、上皮细胞、成纤维细胞等多种免疫和非免疫细胞也可产生[2]。
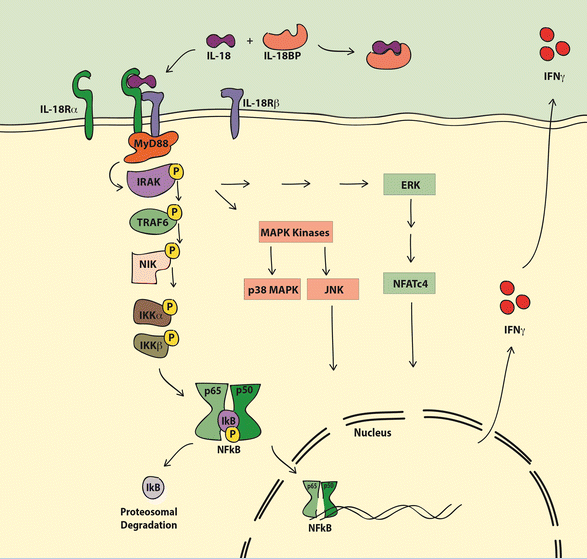
二、IL-18信号通路(如下图)
① 存在于细胞中的IL-18前体,经过加工后释放到胞外;
② 成熟的IL-18与受体复合物IL-18Rα/IL-18Rβ结合;
③ 最终激活NF-κB转录因子,调节基因的转录,产生促炎因子。
IL-18主要通过产生IFN-γ来调节免疫细胞的应答,这种调节依赖于IL-12或IL-15,研究表明,在IL-12/15存在时,IL-18可以诱导IFN-γ的产生,而两者不存在时,则不会诱导或只诱导微量的IFN-γ的产生[3]。
三、IL-18的功能(如下图[4])
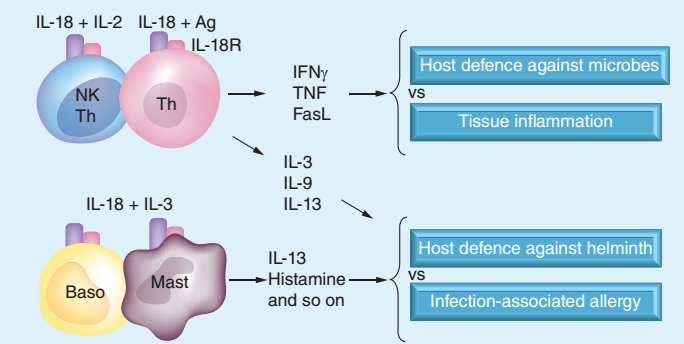
1. 对T细胞的调节
① 在 IL-12 的刺激下,IL-18可以促进Th1细胞的增殖和分泌大量的IFN-γ,更好地清除抗原,尤其是胞内的细菌、真菌和原生动物;
② 在一些其他刺激信号存在时,IL-18 能诱导原始的或者 Th1 极化的细胞产生Th2 细胞因子如IL-13;
③ IL-18对于Treg细胞也有作用,有研究表明 IL-18 可以有效的抑制 Treg细胞的积累和功能[5]。
2. 对NK细胞的调节
① 在 IL-12 的刺激下,IL-18可以促进NK细胞中IFN-γ 的合成和分泌;
② IL-18 可以通过增加穿孔素perforin ,TNF和 FASL 的表达来增加NK细胞的细胞毒性;
③ 对于自然杀伤性 T 细胞(NKT cells),IL-18在 IL-12 的协同作用下可以促进自然杀伤性 T 细胞合成 IFN-γ,在 TCR的刺激下 IL-18 可以增强NKT 细胞产生 IL-4、IL-5、IL-13、GM-CSF、TNF[6]。
另外嗜碱性粒细胞和肥大细胞也可以在IL-18刺激下产生大量的IL-13,释放化学调控因子,如组胺等,来保护机体免受外界病原体的干扰。
四、 IL-18的抗肿瘤作用

Micallef在BALB/c小鼠腹腔接种Meth A肉瘤细胞后,腹腔注射或静脉注射IL-18表现出明显的抗肿瘤作用。且在接种肿瘤细胞前3h和6h各用1μg的IL-18预处理小鼠一次,接种肿瘤的小鼠均能存活,而对照小鼠在3周内全部死亡。体外试验表明,IL-18本身没有抗肿瘤作用,因此其抗肿瘤作用应是通过诱导小鼠体内的NK细胞和细胞毒性细胞而间接发挥的。如下图为IL-18处理后对NK细胞活性的影响[7]。
IL-18抗肿瘤的机制究竟是如何发生的呢?
① 首先激活NK细胞,分泌大量的IFN-γ,使其能够特异性地杀伤肿瘤细胞;
② NK细胞的调节下,CD8+T和CD4+T细胞逐渐活化,CTL发挥杀伤作用,并且CD4+T细胞参与肿瘤特异性免疫记忆的形成;
③ 也可通过激活Th细胞产生的细胞因子增强抗肿瘤效果,如分泌的IL-2可以通过激活单核、巨噬细胞增强杀伤活性。
五、 IL-18在肿瘤免疫治疗中的应用
上述,介于IL-18在免疫调控中的强大功能,其在肿瘤免疫方面中的应用被广泛研究,与其他细胞因子相比,IL-18表现出了更强大的抗肿瘤效应,且毒副作用更低。主要包括以下几方面:
应用1:一项关于肾透明细胞癌的临床I期研究中[8],病人被给予不同剂量的rhIL-18(recombinant human IL-18),结果显示所有病人皆耐受良好,这也提示病人对IL-18的耐受度比IL-12或IL-2高10-1000倍,反应了其低度的优良特性。
应用2:IL-18基因转染的肿瘤细胞体内致瘤性下降,动物存活期延长,表明IL-18是一种具有抗肿瘤作用的新因子,为临床肿瘤治疗提供了一种新的安全有效的手段。
应用3: Tomura[9]等研究了IL-18对NK细胞体外作用的特点,IL-18单独与NK细胞共育,只能产生少量IFN-γ,在有IL-12或IL-2存在时,能产生大量的IFN-γ。然而IL-18与IL-12联合使用具有较强的毒副作用,可使荷瘤小鼠的体重下降、粘膜糜烂、腹泻等。实验提示,这种副作用可能是由于IL-18引起的。因此,明确各个因子的组合及剂量调整也是一个重要研究方向。
综上所述,IL-18作为一种免疫调节因子,可诱导分泌IFN-γ,显著增强Th1型免疫反应,因此若在CAR-T中装上细胞因子IL-18,很可能会增强CAR-T疗效,同时还可减少CAR-T细胞的使用量及全身给药的副作用。另一方面,IL-18对于NK细胞的增强效果也为我们今后的CAR-NK提供了新的思路和靶向。本期就到先到这里了,让我们一起期待IL-18在CAR-T治疗上的神奇疗效吧!我们下期再见~
参考文献
1. Yeku O O, Brentjens R J. Armored CAR T-cells: utilizing cytokines and pro-inflammatory ligands to enhance CAR T-cell anti-tumour efficacy[J]. Biochemical Society Transactions, 2016, 44(2): 412-418.
2. Wawrocki, S., et al., Interleukin 18 (IL-18) as a target for immune intervention. Acta Biochim Pol, 2016. 63(1): p. 59-63.
3. Sedimbi, S.K., T. Hagglof, and M.C. Karlsson, IL-18 in inflammatory and autoimmune disease. Cell Mol Life Sci, 2013. 70(24): p. 4795-808.
4. Tsutsui H, Nakanishi K. Immunotherapeutic applications of IL-18[J]. Immunotherapy, 2012, 4(12): 1883-1894.
5. Carroll, R.G., et al., Distinct effects of IL-18 on the engraftment and function of human effector CD8 T cells and regulatory T cells. PLoS One, 2008. 3(9): p. e3289.
6. Uchida, T., et al., IL-18 time-dependently modulates Th1/Th2 cytokine production by ligand-activated NKT cells. Eur J Immunol, 2007. 37(4): p. 966-77.
7. Micallef, M.J., et al., Interleukin 18 induces the sequential activation of natural killer cells and cytotoxic T lymphocytes to protect syngeneic mice from transplantation with Meth A sarcoma. Cancer Res, 1997. 57(20): p. 4557-63.
8. Robertson, M.J., et al., A dose-escalation study of recombinant human interleukin-18 using two different schedules of administration in patients with cancer. Clin Cancer Res, 2008. 14(11): p. 3462-9.
9. Tomura, M., et al., A critical role for IL-18 in the proliferation and activation of NK1.1+ CD3- cells. J Immunol, 1998. 160(10): p. 4738-46.