2017-08-18
近几年CAR-T因其在白血病等液体瘤上的巨大潜力,被认为是最有前景的肿瘤治疗方式之一,然而依然存在如免疫抑制微环境、T细胞效力不强及细胞毒性等难题制约着CAR-T功效的发挥。前两期我们已经学习了CAR-T的基本知识,本期,我们就为大家介绍,CAR-T疗法中影响T细胞功能(增殖能力和免疫功能)的一些小明星分子,如细胞因子IL-7、IL18、IL-21,IL15等在肿瘤免疫方面的功效。也许它们可以为CAR-T的效力提升打开新的一扇窗。
什么是细胞因子?
细胞因子(cytokine,CK)是一种主要由活化的免疫细胞分泌的、介导和调节细胞功能(免疫反应、炎症反应、造血功能等)的小分子可溶性蛋白质。根据功能不同,可被分为白细胞介素、干扰素、肿瘤坏死因子超家族、集落刺激因子、趋化因子、生长因子等几大类。
细胞因子与肿瘤的关系
近年有实验结果表明:给肿瘤局部注射细胞因子IL-2,大量粒细胞和巨噬细胞被招募至肿瘤区域甚至是渗透到肿瘤内部,致使发生强大的抗肿瘤作用,最终肿瘤退化。除此之外,一些其他的细胞因子如IFN-α、GMCSF等也可以诱导肿瘤细胞死亡,这提示CK在抗肿瘤领域具有的广阔的应用前景。
细胞因子与CAR-T的关系是什么呢?
目前肿瘤免疫疗法CAR-T发展如火如荼,但是依然存在阻碍,如T细胞寿命短,效力不够等,这些问题严重阻碍了CAR-T治愈肿瘤的功效,特别是在实体瘤根治上。鉴于细胞因子的抗肿瘤功能,不难想到,也许共表达这些细胞因子会解决这一难题,并有望成为攻克实体肿瘤的重要手段。
如第四代CAR-T:在第二/第三代CAR-T的基础上共表达一些关键的细胞因子中就表现出了克服实体瘤免疫抑制微环境的能力。
以IL-12为例,系统注射IL-12会引起严重的炎症副反应,但是通过共表达IL-12的第四代CAR-T细胞来实现局部表达后,可以在肿瘤病灶处招募NK细胞,或者直接逆转被耗竭的肿瘤浸润性T淋巴细胞,从而有效克服肿瘤免疫抑制微环境。还有一些研究发现,在CAR-T细胞中共表达某些趋化因子,也可以增强CAR-T细胞的归巢能力。
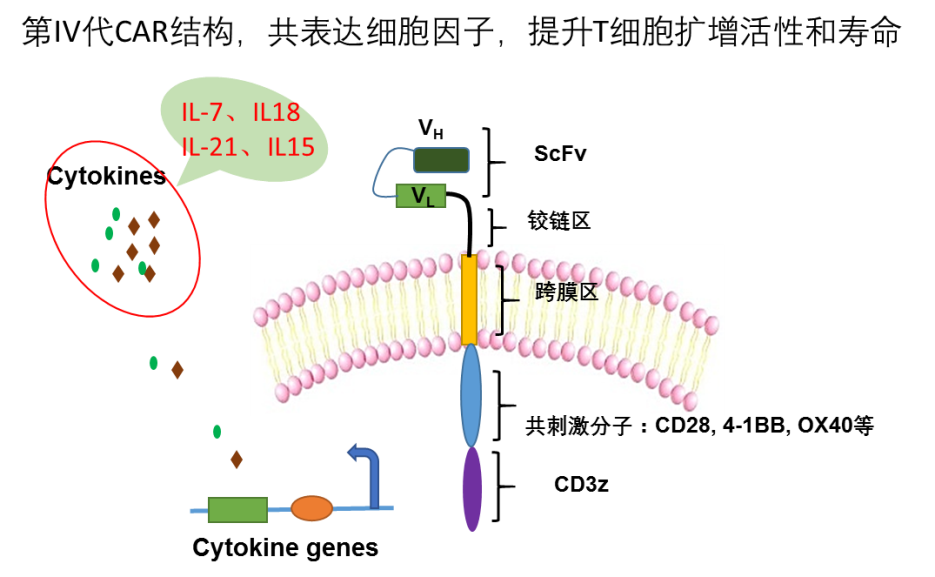
因此,尝试着将具备重要免疫调节能力的细胞因子在CAR-T细胞中共表达,如IL-7、IL18、IL-21,IL15等细胞因子,很可能对T细胞的活性有很大的提升。
本期就先为大家介绍一下细胞因子IL-7的功能及与肿瘤免疫的关系。
人白细胞介素7(interleukin-7,IL7)是一种多效细胞因子,具有广泛的免疫效应。长期以来,对于IL-7的认识一直处于影响B细胞和T细胞的生长、存活及分化[1]。但在近年来,某些研究表明IL-7在抗肿瘤方面有直接或间接的作用。下面就一起来看看IL-7的发现、功能及应用。
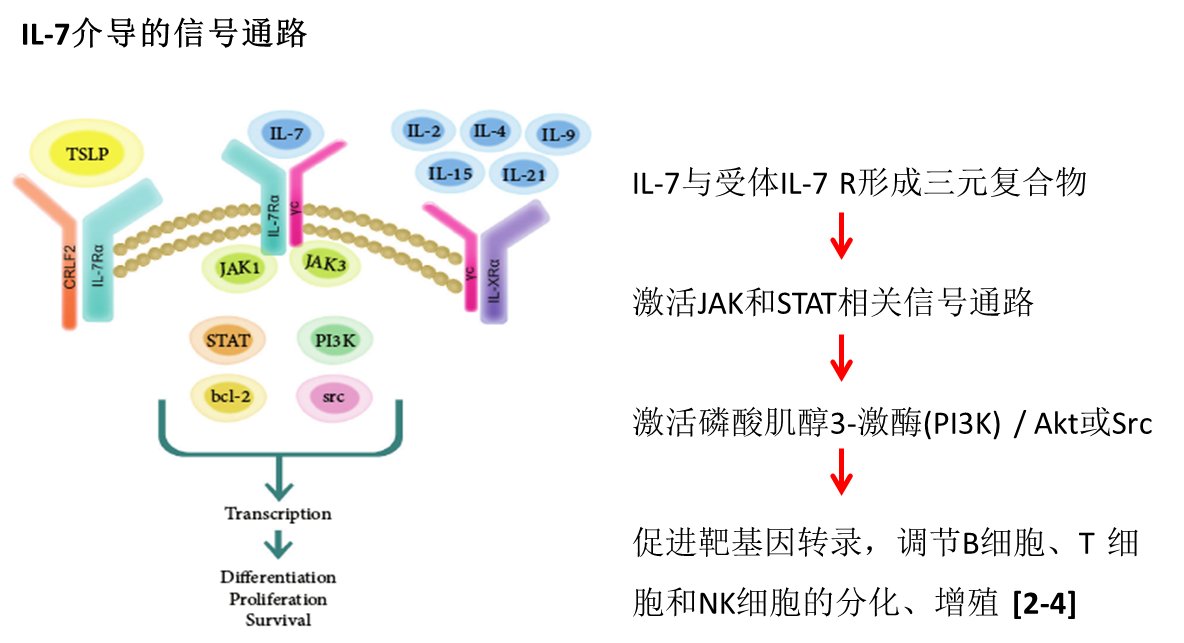
IL-7的发现 1987年Hunt等人在实验中发现,1988年Namen等将其纯化、克隆出来,命名为淋巴细胞生成素-1,同年被命为白细胞介素7。IL-7/IL-7R介导的经典的信号通路如下图一所示[4]:
IL-7与T细胞有什么关系呢?
1. 调控T细胞的发育
T细胞在胸腺发育过程中,受IL-7Rα表达的调控。在TCR介导下也可重新诱导IL-7Rα表达。如图为:IL7/7R调控T细胞的发育。TCR信号持续,IL-7R信号受阻,分化为CD4+单阳性T细胞;TCR信号的终止,IL-7R信号传导,分化为CD8+单阳性T细胞[5]。

2.促进T细胞的增殖
研究发现,IL-7的表达与T细胞增殖密切相关。如用IL-7刺激新鲜T细胞,T细胞可剂量依赖性扩增,包括CD4+和CD8+亚群;敲除IL-7R,T细胞会停止生长;转入IL-7基因可促进CD4+/ CD8+T细胞的增殖。但CD4+和CD8+T细胞对IL-7对有不同的应答效果。IL-7对CD8+T细胞亚群的作用要强于CD4+细胞亚群[6, 7]。
如下图,Lisa A等人在探究IL-7激活T细胞是否与诱导增殖有关实验中,通过给小鼠体内注射IL-7,能够诱导活化状态下T细胞增殖,并且给药时间越久,增殖倍数越大;并且IL-7注射时间大于4天后,CD8+T细胞亚群的增殖倍数要强于CD4+细胞亚群。

3.延长记忆性T细胞的存活时间
IL -7Rα会选择性地表达于初次免疫应答中的小部分效应T细胞,而后转化为中枢性记忆性T细胞。并且IL-7对于记忆T细胞的存活尤为重要。而在淋巴细胞减少症中,IL-15对于记忆性T细胞的作用可以被IL-7取代[8]。
4.抗肿瘤作用
早在1994年,McBride等人将重组人IL-7注射人纤维肉瘤小鼠的肿瘤基底部,发现IL-7能抑制肿瘤生长,甚至使部分小鼠肿块完全消退[9]!!!这是因为重组人IL-7腹腔用药能使正常或荷瘤小鼠脾、淋巴结中白细胞增多,表明外源性注射IL-7体可以诱导了机体抗肿瘤免疫机制。

David H. Lynch等人通过向特异性抗肿瘤的CTL细胞(细胞毒性T淋巴细胞,一种特异T细胞,专门分泌各种细胞因子参与免疫作用;对某些病毒、肿瘤细胞等抗原物质具有杀伤作用),培养基中添加IL-2/4/7,探讨这3种细胞因子对CTL细胞抗肿瘤能力的影响。结果显示IL7是最有效的;单独或与低剂量的IL2组合,CTL的扩增能力增强6-8倍;而只添加IL7时,抗肿瘤能力较对照组强4倍;单独添加IL4或与IL2组合,抗肿瘤能力较对照组低于4倍[10]。
IL-7目前有哪些临床应用呢?
介于IL-7强大的免疫效应,尤其是调节T细胞的增殖、维持其细胞内环境稳定,并能增强T免疫应答的能力等的功能,使得IL-7作为一种免疫调节因子越来越受到关注。
目前将IL-7应用于免疫治疗已进入临床并取得一定的疗效,其中包括黑色素瘤和淋巴瘤、宫颈癌、结肠癌等等。
如Möller等人通过将IL-7修饰自体肿瘤疫苗,经皮下注射给恶性黑色素瘤患者,发现所有患者均耐受瘤苗,副作用少。免疫监测其中8例患者,发现杀伤T细胞数量显著增多。只有其中2例在接种后1天出现低热和轻度流感样症状。
截止目前的临床数据一致证明:IL7具强大的扩增初始T细胞和抗肿瘤能力。并且其副作用少,患者可耐受。这为IL-7用于肿瘤治疗提供了契机。
综上,对IL-7用于肿瘤治疗应用前景予以期待
①制备第四代CAR-T细胞。传统的二代、三代CAR-T细胞在体内的存活时间较短,扩增能力较弱。共表达IL-7可以延长CAR-T细胞的存活时间并提高扩增能力和杀伤肿瘤的能力;
②制备更强大的免疫性能的瘤苗。将IL-7与其他生长因子(如B7)共同转染瘤细胞,可提高瘤细胞的免疫原性,从而诱发机体产生更强的抗肿瘤作用;
③IL-7与其他细胞因子联合使用。IL-2是目前公认具有较强抗肿瘤作用的细胞因子之一,但是临床应用来的毒副作用较大,IL-7副作用少,因此可减少IL-2用量,以减轻毒副作用。
综上所述,IL-7在肿瘤免疫方面发挥着巨大功效,如调节T细胞的增殖、维持其细胞内环境稳定,并能增强T免疫应答的能力等,相信若是IL-7恰当地参与到肿瘤免疫中,如共表达到CAR-T,也许会给CAR-T带来不一样的抗肿瘤的功效,让我们拭目以待。
参考文献:
[1].Two types of mouse T helper cell. IV. Th2 clones secrete a factor that inhibits cytokine production by Th1 clones..
[2].Reconstitution of a functional interleukin (1L)-7 receptor demonstrates that the IL-2 receptor y chain is required for IL-7 signal transduction.
[3].Carrette, F. and C.D. Surh, IL-7 signaling and CD127 receptor regulation in the control of T cell homeostasis. Seminars in Immunology, 2012. 24(3): p. 209-217.
[4].Nguyen, V., A. Mendelsohn and J.W. Larrick, Interleukin-7 and Immunosenescence. Journal of Immunology Research, 2017. 2017: p. 1-17.
[5].Heritable Gene Regulation in the CD4 CD8 T Cell Lineage Choice.
[6]. Human IL-7: a novel T cell growth factor..
[7]. Geiselhart, L.A., et al., IL-7 Administration Alters the CD4:CD8 Ratio, Increases T Cell Numbers, and Increases T Cell Function in the Absence of Activation. The Journal of Immunology, 2001. 166(5): p. 3019-3027.
[8]. Interleukin-7 mediates the homeostasis of naïve and memory CD8 T cells in vivo.
[9].Administration of recombinant human IL-7 to mice alters the composition of B-lineage cells and T cell subsets, enhances T cell function, and induces regression of established metastases..
[10].In vivo evaluation of the effects of interleukins 2, 4 and 7 on enhancing the immunotherapeutic efficacy of antitumor cytotoxic T lymphocytes.