2017-08-02
CAR-T是什么?
①
半个月前,诺华的CTL-019将大概率成为全球首个获批上市的CRA-T疗法的事件,刷爆了整个朋友圈。这一天,对肿瘤免疫疗法领域的人们来说,无疑是非常值得纪念的,因为它开启了肿瘤治疗的新纪元。自2013年《科学》杂志评论将“肿瘤免疫疗法”列为年度突破之首,从那以后,嵌合抗原受体T细胞疗法(CAR-T疗法)作为其中一颗闪耀明星,备受世人瞩目。为了让更多人了解CAR-T这一新兴抗肿瘤技术的过去、现状和未来,我们专门整编资料,推出CAR-T专题栏目,与大家一起扒一扒CAR-T的“八卦”,聊聊关于CAR-T的那些事。

“八卦”1: 原来CAR-T备受关注源于小女孩Emily
CAR-T 疗法在全球范围内受到包括学者、医生、患者、投资人在内的如此大量的关注和期待,起初是源于一个白血病小女孩Emily和她的神奇抗癌经历。
先一起来看看Emily的神奇故事吧!
Emily是一位来自美国加州的小女孩,5岁时不幸被诊断为患上了急性淋巴细胞白血病(ALL),更不幸的是,她在首轮化疗时不慎感染,差点失去双腿,并且病情频繁复发。就在医生们无计可施的时候,宾夕法尼亚大学的科学家们决定采用一种疯狂的、前所未有的治疗方法。
神奇的是,经过这种疯狂疗法后,Emily依然身体健康,五年都没有癌症复发。她可以正常上学,玩耍,学钢琴。为此,还有专门网站介绍她与癌症斗争这几年的生活:http://emilywhitehead.com/。如下图:

那究竟是什么神奇的方法治愈了这个小女孩呢?
治疗过程是这样:
① 医生首先从Emily身体里抽取血液,提取外周血中的白细胞,随后利用改良的艾滋病毒对白细胞进行遗传改造,以使它们攻击癌细胞,并重新注入Emily体内。
② 开始Emily体内的癌化白细胞急剧减少,但这些细胞也攻击了她的身体!Emily连续几天发高烧,甚至产生了幻觉。有医生对她的家人说,她活过当晚的几率只有千分之一……事已至此,似乎这一大胆尝试就要失败。
③ 但奇迹出现了:医生们对Emily使用了一种类风湿性关节炎药物,阻止免疫系统的强烈反应,同时这种药物并未对癌细胞形成保护。Emily在7岁生日那天苏醒,之后身体逐渐康复。
其实,治愈Emily的神奇疗法就是我们本期所说的新兴抗肿瘤技术——CAR-T疗法。
“八卦”2:CAR-T究竟是什么?
l CAR-T基本原理:
CAR-T,全称是Chimeric Antigen Receptor T-Cell,即嵌合抗原受体T细胞免疫疗法,简单来说,给患者自身T细胞进行基因工程修饰,加上嵌合抗原受体(CAR),经过修饰的T细胞识别并攻击带有特定抗原的肿瘤细胞,激活机体自身免疫反应从而达到抗肿瘤效果。

l 关于T细胞:
众所周知,T细胞是免疫系统里最凶猛的“猎人”。T细胞表达的抗体单链的的可变区(scFv)联合T细胞信号区能够调控T细胞的功能和特异性。它们通过自己的受体来感知表面存在特定蛋白质的细胞(对肿瘤细胞来说,是肿瘤相关抗原或肿瘤特异性抗原),然后锁定受感染细胞和癌细胞,并杀死它们。
l 关于CAR分子:
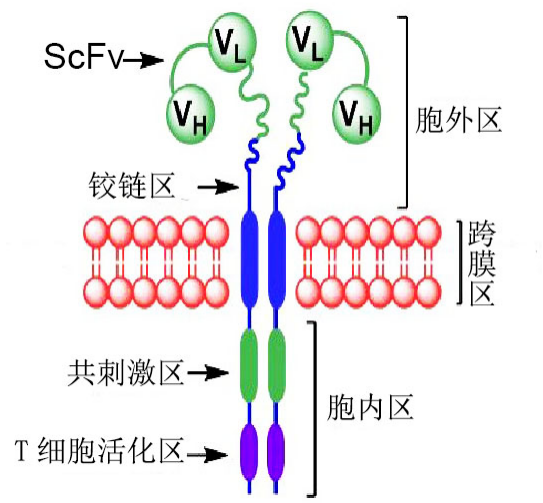 |
CAR一般由一个抗原结合区/胞外区/跨膜区以及一个在结合抗原后能够活化T细胞的胞内信号区组成,如下图所示:
经典的CAR结构图
自1989年以色列免疫学家Zelig Eshhar将免疫球蛋白scFv与FcεRI受体(γ链)或CD3复合物(ζ链)胞内结构域融合并导入T细胞,从而制备出第一代CAR-T以来,CAR-T经历了20多年的发展。
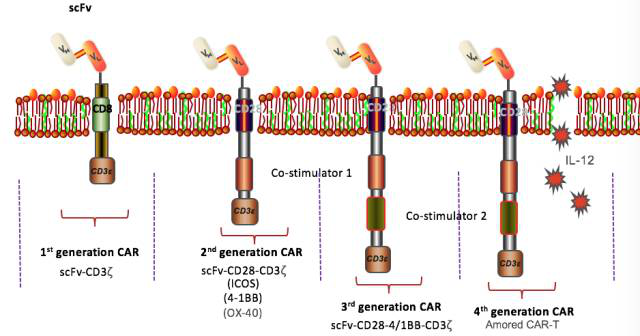
CAR分子大致可分为5代演变:
I代:CD3分子介导的特异性T细胞激活;
II代:胞内段增加共刺激因子,增强细胞杀伤活性;
III代:同时添加两个共刺激因子,提高T细胞增殖能力与杀伤活性;
IV代:整合多种调节基因,如自杀基因,细胞因子释放(如IL-7,IL-15)等;
V代:抗免疫排斥及移植物抗宿主病的通用型CAR-T。如下图所示为1-4代CAR的结构示意图。
目前发展比较成熟的是第2和第3代CAR-T,尤以第2代为主,第4、5代CAR-T也正在广泛开发中。
“八卦”3:CAR-T是如何制备并发挥功效的呢?
如下图所示:
1、从病人体内分离T细胞;
2、给T细胞带上识别肿瘤的“GPS导航”(CAR分子)。即利用基因工程技术给T细胞加入一个能识别肿瘤细胞、同时激活T细胞、最终杀死肿瘤细胞的嵌合受体(本质上是一个融合蛋白);
3、体外大规模扩增CAR-T细胞,使其数量达到治疗水平;
4、将体外培养的CAR-T细胞回输至病人体内;
5、CAR-T在患者体内发挥功能;遗传改造而表达了嵌合抗原受体的CAR-T细胞一旦发现癌细胞,不仅会杀死它,还会开始分裂,创造出庞大的灭癌大军。

CAR-T为代表的T细胞疗法过程简图
“八卦”4:CAR-T疗法的神奇之处在哪里?
据报道,最早接受CAR-T治疗的有30位白血病病人,他们已尝试了各种可能的治疗手段,包括化疗,靶向治疗等,其中15位甚至进行了骨髓移植,但是都不幸失败。通常情况下,他们的生存时间不可能超过半年。按照我们中国人的说法就是死马当作活马医,他们成了第一个吃CAR-T这个螃蟹的人。结果这批人震惊了世界:27位病人的癌细胞治疗后完全消失!20位病人在半年以后复查,仍然没有发现任何癌细胞!
当前无论是中国还是美国,CAR-T靶向的是大多数重要组织不表达或相对可损耗组织表达的肿瘤相关抗原(tumor associated antigen, TAA)。其中主要是集中于对CD19、CD20和CD22作为靶抗原的CAR-T细胞用于治疗B细胞性肿瘤的研究。
以CD19为例,它不但表达于所有正常的B细胞表面,同时也表达于多数恶性增殖的B细胞表面。事实上,即便靶向CD19的治疗会导致成熟B细胞的损耗,但这种副作用也只是暂时的且可恢复的;而由于CD19在造血干细胞中不表达,使用抗CD19的CAR-T细胞进行治疗,其毒性也被限制于B细胞再生障碍性贫血。这种“on target/off tumor”毒性在治疗B细胞性白血病中是可以忍受的。
同时,大量研究表明,实体瘤肿瘤微环境的免疫抑制作用极强,一方面免疫细胞不易进入实体瘤内部;另一方面,即便CAR-T细胞进入肿瘤组织中,由于强烈的免疫抑制环境使其抗肿瘤免疫功能也难以正常发挥,这也是CAR-T细胞目前主要用于治疗血液系统肿瘤的一重要原因。而其余研究较多的靶点有Her2、GD2、CEA、mesothelin等。
“八卦”5:CAR-T疗效惊人,已成为越来越多制药公司的新宠
CAR-T疗效如此惊人,目前已经涌现了一大批药物巨头参与CAR-T的研发与临床转化,这其中就包括诺华、Juno、Kite Pharma、CBMG、Cellectis等。这些大型制药公司都已经拥有各自的CAR-T产品和注册的临床研究,值得一提的是,今年7月12日, FDA肿瘤药物专家咨询委员会(ODAC)以10:0的投票结果一致推荐批准诺华CAR-T疗法Tisagenlecleucel(CTL-019)上市。据称FDA将在10月3日前依据专家意见做出最终审批决定。CTL-019申请的适应症是复发或难治性儿童和年轻成人急性淋巴细胞白血病(ALL),这意味着CTL-019极有可能成为全球首个获批上市的CAR-T产品。
说到这里,是不是很激动人心?不过限于篇幅,我们这期的介绍先到此为止,欲知后事如何,且听下回分解——CAR-T的研发现状。欢迎继续关注我们的栏目,我们下期再聊!
参考资料:
1. Curran, Kevin J., Hollie J. Pegram, and Renier J. Brentjens. "Chimeric antigen receptors for T cell immunotherapy: current understanding and future directions." The journal of gene medicine 14.6 (2012): 405-415.
2. Emily 故事源自http://emilywhitehead.com/网站
3. 部分内容,摘自菠萝的《癌症·真相》一书