

2019-10-28
CAR-T疗法在恶性血液肿瘤中展现出的强大实力,使其逐渐成为近年来最有前景的肿瘤免疫疗法,然而血液肿瘤(非实体瘤)仅仅是众多癌症中较小的一部分,如2019年最新的全球癌症数据指出:约90%的癌症发病率都是由实体瘤引起,但关于实体瘤的细胞治疗临床试验却很少。
如下图所示:2019年发表在Nature Reviews Drug Discovery的数据,自1993年开始的所有细胞治疗试验中,只有一半是针对实体瘤(1203项中有596项)(图1)。
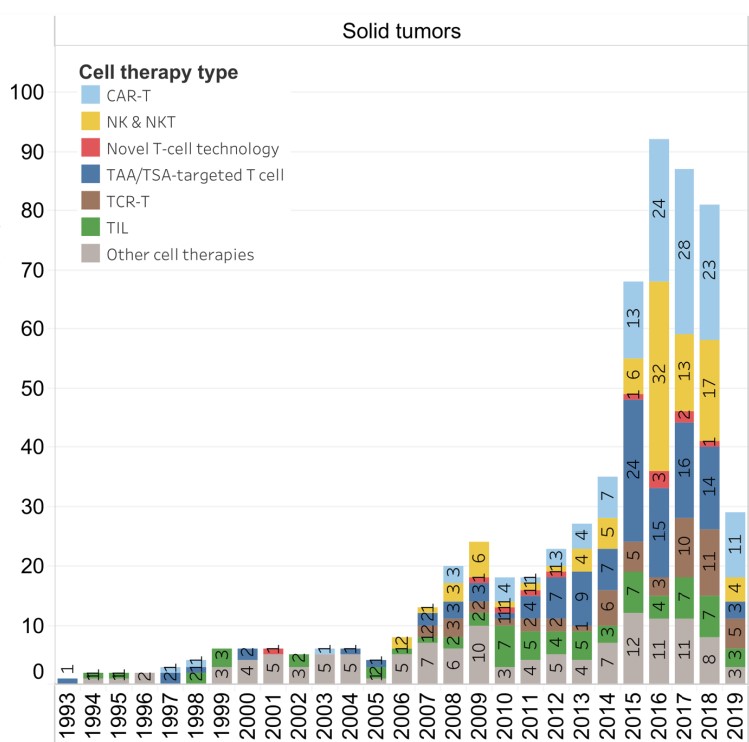
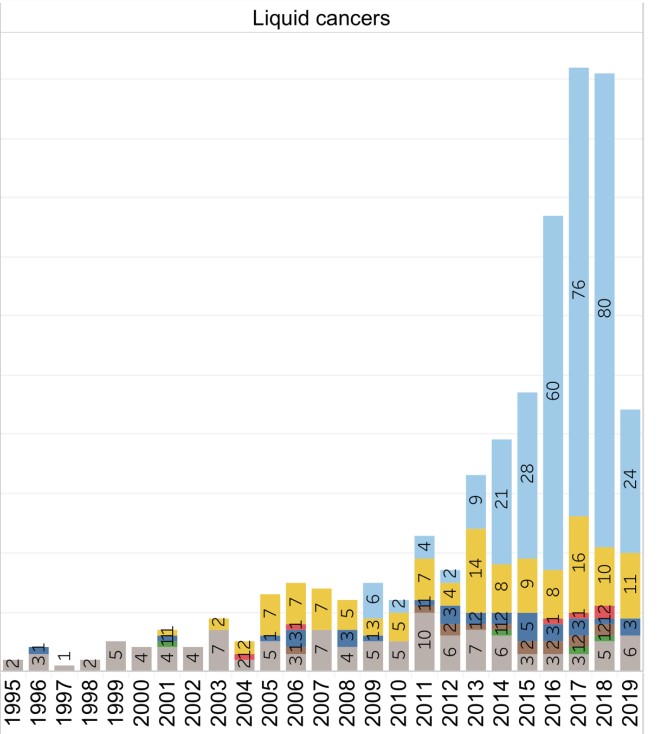
图1. 实体瘤和血液肿瘤的细胞治疗试验比较
如表1,大部分细胞治疗临床研究都集中在少数癌种,如黑色素瘤(79项)、脑癌和中枢神经系统癌(75项)、肝癌(57项),而发病率较高的前列腺癌、乳腺癌、肺癌等都相对较少[1]。这些趋势表明,与血液肿瘤相比,细胞治疗实体瘤才是抗癌的主战场,同时面对的挑战也更大。
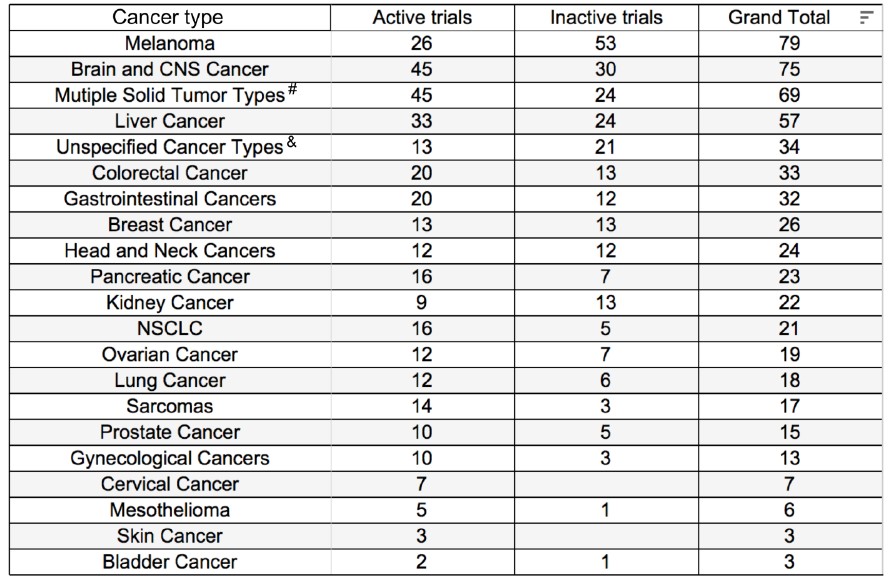
表1. 596例实体瘤试验的总结
CAR-T疗法在实体瘤中的挑战
截至目前,全球已有两款CAR-T产品获批上市,且都是在血液肿瘤领域。而CAR-T在实体瘤上的临床疗效,远不能令人满意。究其原因,主要在于实体瘤的细胞疗法存在不少难点,如不同类型实体瘤的异质性大、缺乏独特的肿瘤相关抗原作为CAR-T靶点、T细胞无法有效归巢到肿瘤部位、CAR-T细胞持续性不够以及肿瘤内复杂的微环境对免疫有抑制作用。具体以下:
1.强大的免疫抑制微环境
肿瘤免疫微环境(tumor immune microenvironment,TIME)代表了实体瘤的复杂生态系统,涉及免疫细胞,癌细胞,基质细胞,细胞因子,趋化因子和细胞外基质之间的相互作用。TIME形成高度免疫抑制的环境促进肿瘤增殖、存活和转移。肿瘤相关巨噬细胞(Tumor-associated macrophages,TAM),癌症相关的成纤维细胞(cancer-associated fibroblasts,CAF)和肿瘤细胞都可以分泌抑制性细胞因子和趋化因子。抑制性代谢产物的产生,刚性细胞外基质导致的迁移失败,抗原呈递不佳,长期T细胞受体(TCR)信号及肿瘤细胞和基质细胞的抑制性受体表达都可能对免疫系统有效的抗肿瘤功能构成强大的障碍。迄今为止,CAR-T细胞在实体瘤中的疗效还受到限制,部分原因是免疫抑制性肿瘤微环境。实体瘤中复杂的TIME,有利于具有物理屏障、多种免疫抑制机制及多种生化因素的肿瘤进展,导致CAR-T细胞疗法在癌症患者临床试验中的疗效有限。
2.高抗原异质性
实体瘤中用于CAR-T细胞疗法的抗原一般为肿瘤特异性抗原(tumor-specific antigen,TSA),如EGFRvIII、前列腺癌抗原PSA、黑色素瘤相关突变抗原1(MUM1)等,其在肿瘤细胞中高表达,正常细胞中不表达或低表达,然而这些抗原在同种肿瘤类型的不同患者中具有高度异质性,使得CAR-T疗法的疗效受限。因为抗原的高度异质性,每位患者都需要找到合适的TSAs,然后构建特定的CAR-T细胞用于治疗,这种方法非常复杂且费用高昂,大多数患者不能承受。
因此,尽管TSAs是构建CAR-T细胞的理想靶点,但目前的CAR-T疗法中很少有使用TSAs成功的案例。肿瘤相关抗原(tumor-associated antigen,TAA)在实体瘤CAR-T疗法中也被广泛探究,如Mesothelin、CEA及MUC1等,但靶向TAAs易对正常组织进行杀伤产生脱靶毒性。此外,还存在一类替代抗原也被广泛研究,包括成纤维细胞活化蛋白(fibroblast activation protein,FAP)和血管内皮生长因子受体2(vascular endothelial growth factor receptor-2,VEGFR-2)。此类抗原不表达在肿瘤细胞而是在肿瘤相关纤维母细胞和肿瘤血管中表达,对肿瘤细胞形成支撑位点,靶向这些抗原可通过阻碍基质形成或血管生成破坏肿瘤形成。
3.密集的细胞外基质
特定的肿瘤类型与独特的肿瘤基质(extracellular matrix,ECM)相关。如多形性胶质母细胞瘤和乳腺癌包含以巨噬细胞为主的基质;在浸润性乳腺癌中,与肿瘤相关的巨噬细胞可占肿瘤总量的50%以上,占与肿瘤相关的白细胞总数的80%。然而,成纤维细胞是结肠癌基质中的主要成分。胰腺癌则与特别丰富的间质有关,其特征在于致密的增生性浸润。独特的胰腺癌基质对疾病的侵袭性很重要,并损害化学疗法和放射疗法的有效性。多项研究表明,独特的基质成分可能与疾病预后相关。
例如,TAM与人类神经胶质瘤和乳腺癌的不良预后有关。此外,CAF与乳腺癌、口腔鳞状细胞癌和食道癌的不良预后有关。如图2所示,在ECM中,癌细胞和驻留成纤维细胞均可分化为CAF进而修饰ECM。ECM束缚及释放的生长因子和趋化因子,以及肿瘤内部细胞新陈代谢变化,都可形成促进肿瘤生长的肿瘤微环境。此外,CAF产生的细胞因子,如TGF-β和PDGF,可刺激血管细胞的血管新生[2]。
图2.ECM在肿瘤进展和转移中的潜在作用
在实体瘤中,胰腺导管腺癌(PDAC)具有特别突出的基质区室,部分特征在于突出的CAF群体和致密的胶原蛋白丰富的ECM。该ECM已被证明可以限制PDAC肿瘤微环境(TME)中的血管灌注,其可能原因是血清利用率低,PDAC环境营养不良。
CAR-T疗法在实体瘤的进展
从以上描述可以得知,实体瘤的复杂性和多样性,使得实体肿瘤的疗效并不如人意。CAR-T细胞若想成功攻克肿瘤细胞,首先需要将CAR-T细胞转运到肿瘤病变处。一旦它们在附近聚集,必须有效地渗入肿瘤,在迁移到实体瘤病灶后,CAR-T细胞必须克服敌对的免疫抑制因子才能引起特异性细胞毒性[3],如图3所示。
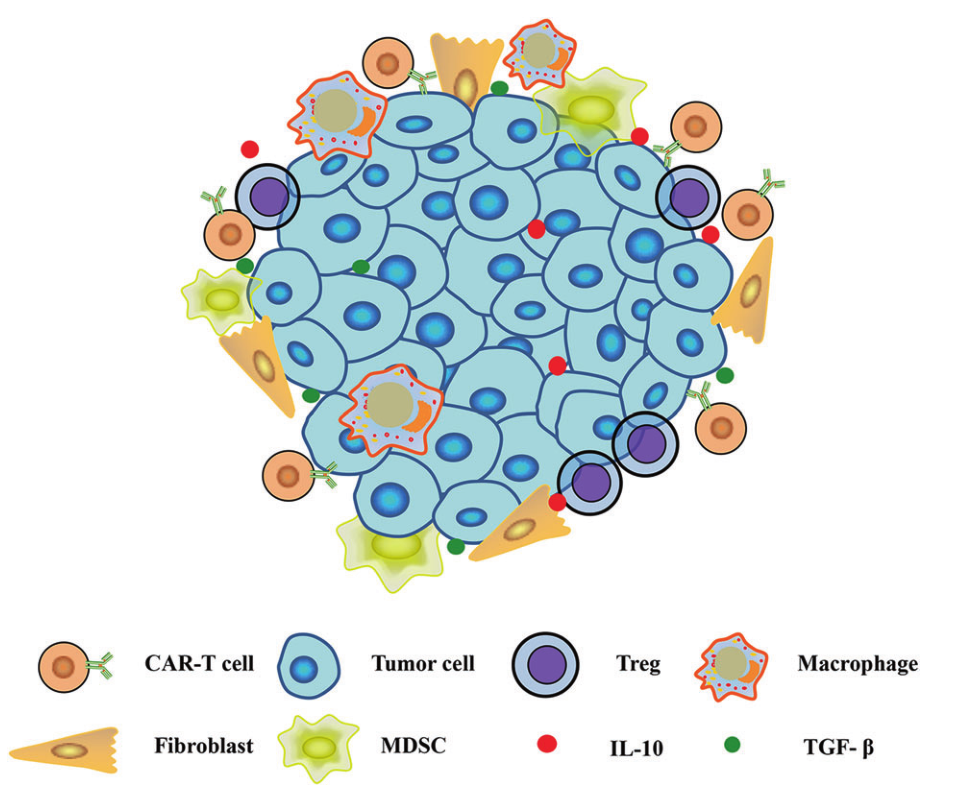
图3. 实体瘤免疫抑制微环境
因此,针对上述难题,科学家们通过向T细胞中引入新的共刺激域,细胞因子基因以及细胞因子受体等策略来增强CAR-T细胞的持久性和抗肿瘤活性。
1.促进T细胞运输至肿瘤部位
促进运输主要有2种策略:
使用趋化因子受体修饰CAR-T细胞;修饰的T细胞可特异性结合肿瘤产生的趋化因子,从而改善CAR-T细胞向肿瘤部位的归巢。已经证明,增加间皮素CAR-T细胞和GD2 CAR-T细胞中CCR2b表达,由于CAR-T细胞向肿瘤病变的迁移增加,而导致恶性胸膜间皮瘤和神经母细胞瘤的抗肿瘤作用得到改善。除了CCR2表达外,CCR4共表达可改善CD30 CAR-T细胞向分泌CCL17(CCR4的配体)的CD30+ HL的归巢,从而改善抗淋巴瘤的作用。
2.改善免疫抑制微环境
在实体瘤中,即使CAR-T细胞能够迁移到肿瘤部位,CAR-T细胞也面临着敌对的肿瘤微环境(TME)。实体瘤通常会被大量的免疫抑制细胞浸润,包括M2肿瘤相关巨噬细胞,髓样抑制细胞(MDSC)以及调节性T细胞(Tregs)和B细胞,它们可保护恶性细胞免受免疫细胞的抗肿瘤活性。此外,免疫抑制细胞因子和抑制性免疫检查点在肿瘤的发病机理和转移中起着至关重要的作用,并限制了癌症免疫疗法的治疗潜力。因此,建立有利的TME以开发在癌症免疫治疗中的疗效,抑制肿瘤诱导的免疫抑制机制至关重要。主要包括以下方面:
1)使用针对免疫检查点的免疫调节剂来增强TME中的内源性抗肿瘤免疫力
T细胞表达共抑制受体,以降低CAR-T细胞的抗肿瘤活性。近年来,PD-1作为促进CAR-T细胞效力的潜在靶标被大量研究。操纵PD-1在CAR-T细胞上表达的策略包括同时使用PD-1/PD-L1阻断抗体,去除T细胞中PD-1表达及分泌自分泌分子诱导CAR-T细胞阻滞PD-1/PD -L1。Noman等人证明了阻断PD-L1可防止MDSC抑制T细胞。阻断TME中PD-L1+ MDSCs和Treg可增强CEA CAR-T细胞的抗肿瘤能力。表达PD-1抗体的CAR-T细胞用于实体瘤治疗的多项临床试验正在进行中(NCT03030001,NCT02873390,NCT03179007,NCT03182816,NCT03182803,NCT03615313)。
2)靶向TME中的调节细胞
例如Treg,TAM和MDSC。在异种移植肉瘤模型中,GD2 CAR-T细胞与MDSC消耗联合给药可产生显着的抗肿瘤功效,而单独的CAR-T细胞仅引起最小的抗肿瘤活性。
3)修改TME的细胞因子和趋化因子
如已开发出可以将IL-4的负信号(TME中经常存在的细胞因子)转换为IL-7的正信号的嵌合开关受体,用于设计前列腺干细胞抗原(PSCA)特异性的CAR-T细胞。具有可诱导的IL-18的CAR-T细胞使免疫细胞内的平衡朝着Th1急性期反应倾斜,从而减少免疫抑制细胞(如Tregs和CD206+巨噬细胞)的数量,从而导致对肿瘤的免疫增强。前列腺特异性膜抗原CAR-T细胞共表达显性阴性的TGF-β受体,在侵袭性前列腺癌中可观察到增殖增加,细胞因子分泌增强,耗竭减弱,体内长期持久性及通过CAR-T细胞根除恶性肿瘤。
目前一项共表达TGF-βRⅡ的CAR-T细胞的临床试验正在进行中,以评估对复发和难治性转移性前列腺癌患者的治疗作用(NCT03089203)。此外,具有增强的细胞因子分泌功能的工程CAR-T细胞,称为TRUCKs。在临床前试验中,靶向MUC16可分泌IL-12的CAR-T细胞已根除卵巢癌。具有自分泌IL-12表达的工程CAR-T细胞通过促进CD8+ T细胞功能并绕开抑制性TME而改善抗肿瘤活性。目前正在进行MUC16 TRUCKs对实体瘤治疗的临床试验(NCT02498912)。溶瘤病毒局部递送趋化因子RANTES和细胞因子IL-15显着增加了抗GD2 CAR-T细胞的持久性,并提高了成神经母细胞瘤细胞小鼠的存活率。
VEGFR-1特异性CAR-T细胞可延迟肿瘤的生长和形成并抑制异种移植肿瘤模型中肺转移。大量研究表明,γ链(γc)家族细胞因子可用于增强CAR-T细胞的免疫力,IL-2、IL-4、IL-7、IL-15和IL-21可以减轻TME中免疫抑制因子的作用,并显著提高CAR-T疗效。
3.根据TME选择合适抗原
TME不仅对肿瘤的生长至关重要,而且在肿瘤中产生了强大的免疫抑制位,因此肿瘤细胞可以逃脱宿主的免疫监视。随着针对实体瘤的CAR-T治疗的临床试验数量不断增加,现对这些试验进行总结,以探索基于特定TME选择合适靶点的方法。如下图为针对不同的癌症的抗原分类及相应的临床试验数目。
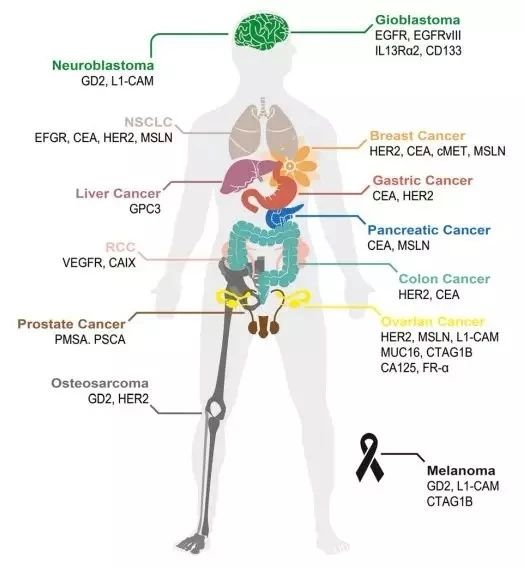
图4. 不同癌症的CAR-T靶点分类
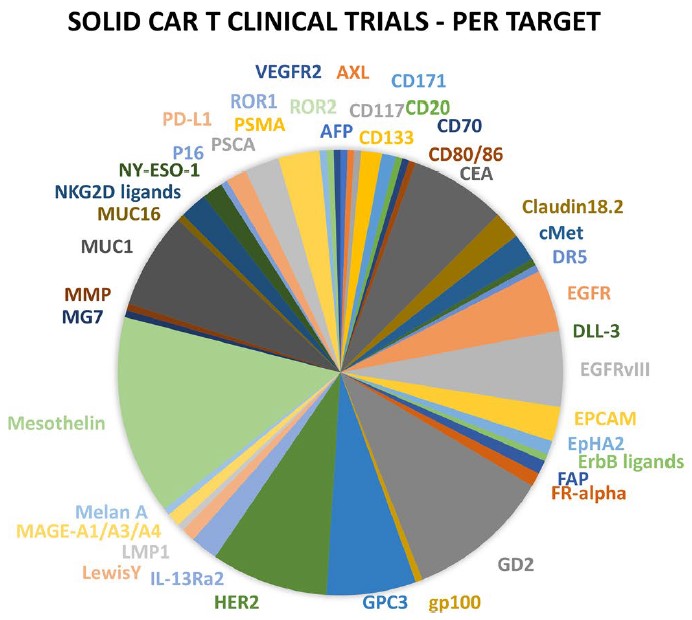
图5. 针对实体瘤的CAR-T临床试验
CAR-T治疗最常用的靶标是表面抗原,例如用于结直肠腺癌的癌胚抗原(CEA),用于恶性胸膜间皮瘤的成纤维细胞活化蛋白,用于神经母细胞瘤、成胶质细胞瘤、黑素瘤和骨肉瘤的双神经节苷脂GD2,人类表皮生长因子受体 2(HER2)用于HER2阳性肉瘤,间皮素用于胰腺癌,IL-13受体α(IL-13Rα)用于神经胶质瘤,突变体αvβ6整联蛋白用于胰腺肿瘤[4]。下面举几个例子:
1)GBM-CAR-T的理想靶点:EGFRvⅢ
针对胶质母细胞瘤(GBM,Glioblastoma)相关抗原的CAR-T治疗包括EGFRvⅢ,IL-13Rα2,HER2和EphA2,其中EGFRvⅢ特异的CAR-T治疗在临床前模型中取得了最大的进展,从而加快了将该新疗法转化为临床应用的速度。EGFRvⅢ在CD133+胶质母细胞瘤癌症干细胞中很常见,且具有高度的自我更新和肿瘤启动能力。据报道,宾夕法尼亚大学的一项临床试验用抗EGFRvⅢ CAR-T细胞治疗10例EGFRvⅢ阳性GBM患者是安全的,并且没有脱靶效应,CRS及与野生型EGFR交叉反应,但在复发切除的肿瘤组织中EGFRvⅢ表达会随着时间的流逝而丢失。GBM中抗原丢失和肿瘤内以及个体间异质性的特征增加了CAR-T细胞治疗的难度,在这种情况下,找到其他靶标以减少免疫逃逸的机会并增强抗肿瘤免疫反应尤其重要。目前临床研究正在进行针对GBM中靶向IL-13Rα2和HER-2的CAR-T细胞总体安全性和疗效的评价。
2)适用于多种实体瘤的CAR-T靶点:Mesothelin
间皮素(Mesothelin)是一种TAAs,在各种实体瘤中高表达如上皮样间皮瘤、肝外胆道癌、胰腺导管腺癌(PDAC)、卵巢癌和胃癌。现有报道数据表明,其表达增加与卵巢癌、胆管癌、胰腺癌、三阴性乳腺癌和肺腺癌患者预后较差有关。鉴于Mesothelin特异性CAR-T细胞具有抗肿瘤作用,在上皮性卵巢癌,恶性上皮性胸膜间皮瘤和PDAC患者中进行的临床试验产生了直接的抗肿瘤功效(NCT02159716)。正在进行的各种Mesothelin特异性CAR-T试验结果表明,Mesothelin是表达Mesothelin的实体瘤中CAR-T疗法的有效靶标(NCT02414269和NCT02465983)。
3)表面糖脂抗原CAR靶点:神经节苷脂GD2
GD2在多种肿瘤细胞中高度过表达,包括神经母细胞瘤、星形细胞瘤、视网膜母细胞瘤、尤因氏肉瘤、横纹肌肉瘤、小细胞肺癌、黑色素瘤和乳腺癌,但在包括中枢神经系统(主要在神经元细胞和间充质干细胞)在内的正常组织中表达受限,在周围神经和皮肤黑素细胞中低表达。迄今为止,抗GD2-CARs已在神经母细胞瘤,骨肉瘤和黑色素瘤等多种疾病的临床前和临床试验中进行了深入研究。Pule等产生EBV特异性T细胞以识别GD2,并将这些GD2 CAR-T细胞注入患者体内以治疗神经母细胞瘤,发现病毒特异性GD2 CAR-T细胞持续存在并表现出中等的抗神经母细胞瘤活性。在抗GD2 CAR-T细胞在黑色素瘤中的细胞毒性研究中发现GD2阳性黑色素瘤细胞在体外的特异性裂解。在PDX模型中,静脉或瘤内注射抗GD2 CAR-T细胞的小鼠其肿瘤得到快速的消退。目前以GD2为靶点的CARs在多种实体瘤中进行多项临床试验(NCT02992210,NCT02761915,NCT03373097和NCT02765243)。
4.靶向胞外基质
大多数CAR-T细胞靶向癌细胞上的抗原,但在非恶性肿瘤相关基质细胞表面表达的一些抗原靶标也适合CAR-T细胞如FAP,FAP是一种跨膜丝氨酸蛋白酶,90%以上的上皮癌非恶性肿瘤相关基质细胞中高表达,而在健康的成人组织中却低表达。选择此类靶点存在以下优点:
基质细胞比癌细胞具有更高的遗传稳定性,更容易以稳定的方式用抗原靶标靶向基质细胞。
肿瘤基质可支持肿瘤细胞生长,侵袭和血管生成,从而形成针对靶向肿瘤免疫疗法的物理屏障,并通过吸引免疫抑制细胞,调节T细胞功能和表达抑制分子来建立免疫抑制位。而靶向基质细胞可破坏这些功能,同时延缓肿瘤生长。
迄今为止,已有数个使用抗FAP CAR-T细胞的研究成果。苏黎世大学赞助的针对FAP的CAR-T治疗已进入I期临床试验,用于恶性胸膜间皮瘤患者(NCT01722149)。
目前,大约有三分之一的CAR-T临床试验正在评估CAR-T治疗实体瘤的方法,现在有多家公司正在进入该领域。近年来,通过开发新方法以克服实体瘤引起的障碍并针对这些特定适应症优化CAR-T治疗,如增加T细胞对肿瘤可及性和CAR-T在肿瘤部位的浸润,中和或调节免疫抑制性TME,改善CAR-T功能,减轻潜在的毒性。除了以上策略之外,使用基因编辑技术如CRISPR-Cas9构建通用型CAR-T细胞,以使其临床应用广泛普及也是目前的重要发展方向。
参考文献
[1]. Jia Xin Yu, Vanessa M. Hubbard-Lucey and Jun Tang. The global pipeline of cell therapies for cancer. Nature Reviews Drug Discovery.
[2]. Eble JA, Niland S. The extracellular matrix in tumor progression and metastasis. Clin Exp Metastasis. 2019 Jun;36(3):171-198.
[3]. Dan Li, Xue Li, Wei-Lin Zhou, et al. Genetically engineered T cells for cancer immunotherapy. Signal Transduction and Targeted Therapy. 35 (2019): 1–17.
[4]. Springuel L, Lonez C, Alexandre B, et al. Chimeric Antigen Receptor-T Cells for Targeting Solid Tumors: Current Challenges and Existing Strategies. BioDrugs. 2019 Jul 30.